Поиск:
- Все
- А
- Б
- В
- Г
- Д
- Е
- Ё
- Ж
- З
- И
- Й
- К
- Л
- М
- Н
- О
- П
- Р
- С
- Т
- У
- Ф
- Х
- Ц
- Ч
- Ш
- Щ
- Э
- Ю
- Я
- Все
- A
- B
- C
- D
- E
- F
- G
- H
- I
- J
- K
- L
- M
- N
- O
- P
- Q
- R
- S
- T
- U
- V
- W
- X
- Y
- Z
- Изотермическая амплификация LAMP
Изотермическая амплификация (loop-mediated isothermal amplification, LAMP) — технология амплификации ДНК, которая, в отличие от ПЦР, не требует температурного цикла. Для LAMP используется не термостабильная полимераза Taq, как для ПЦР, и полимераза Bst (из Bacillus stearothermophilus). Bst менее термостабильна, чем Taq, но она вытесняет вторую цепь ДНК сама, поэтому в первом шаге ПЦР — расплавлении нитей ДНК — нет необходимости, и реакция проходит при постоянной температуре 60–65оС. Благодаря тому, что LAMP проходит весьма быстро (за 20 мин или быстрее), не требует термоциклера, а продукт реакции легко детектируется, она считается перспективной дешевой альтернативой ПЦР для диагностических приложений. Изотермическая петлевая амплификация, совмещенная с обратной транскрипцией (RT-LAMP), может использоваться для детекции РНК.
Метод LAMP описал Цугунори Нотоми в 2000 году. Нотоми предложил использовать не два, а четыре праймера — два внутренних и два внешних, узнающих в общей сложности шесть различных участков искомой ДНК. (Внутренние узнают по два участка каждый.) Праймеры организованы таким образом, что при амплификации формируют петли, соединяющие амплифицированные фрагменты ДНК.
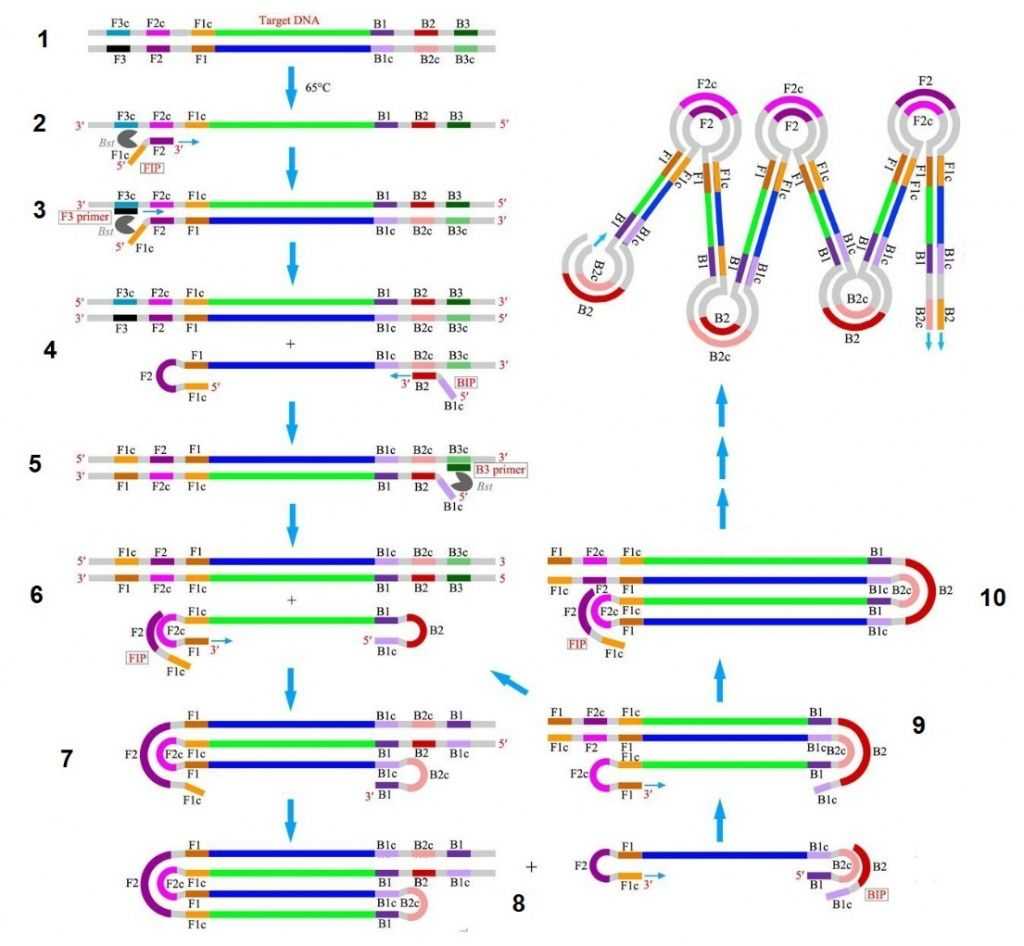
1. Раствор, содержащий ДНК-мишень, нагревается до 65оС.
2. С ДНК-мишенью (для простоты нарисована одна нить) взаимодействуют прямые праймеры. Внутренний праймер FIP (forward inner primer) комплементарен участку F2c в ДНК, а его «хвост» F1c имеет такую же последовательность, как одноименный участок ДНК, и, следовательно, комплементарен участку F1 новой нити, которая синтезируется с этого самого праймера.
3. Внешний прямой праймер F3 комплементарен участку F3c ДНК-мишени.
4. Нить ДНК, которая начала синтезироваться с внешнего праймера, вытесняет из двойной спирали (благодаря вымещающей активности Bst-полимеразы) нить, синтезированную с внутреннего праймера. С вытесненной нитью взаимодействует внутренний обратный праймер BIP (backward inner primer), а ее 5’-конец образовал петлеобразную структуру.
5. Внешний обратный праймер B3 комплементарен участку B3c, с него синтезируется новая нить и вытесняет нить, синтезированную с внутреннего праймера.
6. Вытесненная из дуплекса нить со шпильками на обоих концах — такую структуру называют гантелеобразной (dumbbell structure). Участок F1 выступает в роли праймера: полимераза может наращивать его 3’-конец. Но при этом новый праймер FIP может отжигаться на F2c.
7. Результат полимеризации с двух праймеров. Образуется новая шпилька.
8, 9. С праймера B1 синтезируется новая нить, вытесняя старую, и возникает Л-образная структура. С вытесненной нитью и новым праймером BIP повторяются шаги 6, 7
10. С однонитевой петлей взаимодействует новый праймер FIP. Цикл повторяется, зигзагообразная структура растет.
У LAMP есть множество различных модификаций, например, использование дополнительной пары «петлевых» праймеров, и др.


 Меню
Меню





 Все темы
Все темы